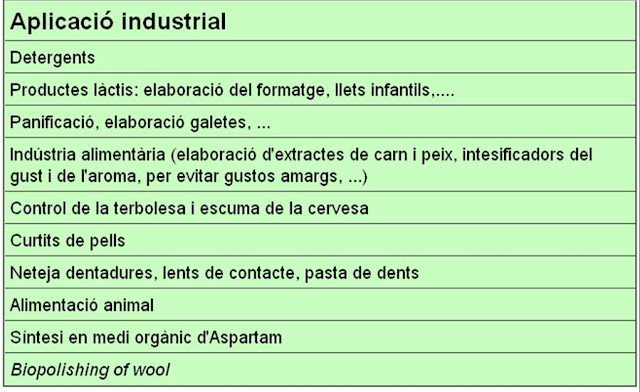
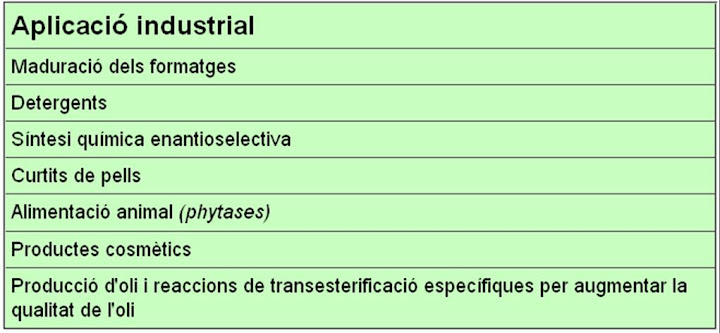
Des de fa molts anys els enzims s'utilitzen en la indústria de l'adob de les pells i més recentment s'utilitzen en la indústria tèxtil.
 Adobar les pells significa: donar a les pells o els cuirs el tractament o els tractaments adequats per tal de transformar-los en una matèria que, a més de no ésser putrescible, posseeixi les propietats i l'aspecte necessaris per a l'aplicació pràctica a què vagin destinats. També es pot definir com: Estabilitzar el teixit col·lagènic de la pell per tal de fer-lo imputrescible i menys hidrolitzable.
Adobar les pells significa: donar a les pells o els cuirs el tractament o els tractaments adequats per tal de transformar-los en una matèria que, a més de no ésser putrescible, posseeixi les propietats i l'aspecte necessaris per a l'aplicació pràctica a què vagin destinats. També es pot definir com: Estabilitzar el teixit col·lagènic de la pell per tal de fer-lo imputrescible i menys hidrolitzable.
L'adobat de les pells és un procés químic i enzimàtic que consisteix en reforçar l'estructura proteica del col·lagen de la capa de la dermis, eliminant els altres compostos presents, com pèls, lípids i proteïnes solubles. El sistema més antic per adobar el cuir o les pells consisteix en utilitzar extractes vegetals rics en tanins. Aquest procés però pot tardar diverses setmanes o mesos. Al segle XIX es va introduir l'adobat químic que utilitza sulfat de crom. Abans, però, d'aquest procés calen altres passos (curing, soaking i dehairing) on s'utilitzen diversos enzims. Els principals enzims utilitzats són les proteases que ens ajudaran a degradar els pèls de la pell i altres proteïnes dels animals i les lipases per treure el greix. S'aconsegueix així augmentar la qualitat del producte final i reduir l'impacte mediambiental del procés:


Les fibres tèxtils abans de teixir-les han de ser reforçades per a què no es trenquin. Per això s'afegeixen compostos que s'adhereixin a les fibres. El midó, combinat amb petites quantitats d'altres substàncies com gelatina i carboximetilcel·lulosa (cel·lulosa tractada per fer-la soluble en aigua), és un dels compostos més utilitzats.
 Després de teixir cal treure aquest midó i en aquest procés anomenat desizing és on ara s'utilitzen les alfa-amilases (els preparats que es venen per fer aquest procés, a part d'activitat amilasa, també tenen activitats proteasa i cel·lulasa). Abans s'utilitzaven tractaments amb àcids o bases que a part dels efectes negatius dels residus que s'originaven sobre el medi ambient, eren tractaments més agressius amb les fibres dels teixits.
Després de teixir cal treure aquest midó i en aquest procés anomenat desizing és on ara s'utilitzen les alfa-amilases (els preparats que es venen per fer aquest procés, a part d'activitat amilasa, també tenen activitats proteasa i cel·lulasa). Abans s'utilitzaven tractaments amb àcids o bases que a part dels efectes negatius dels residus que s'originaven sobre el medi ambient, eren tractaments més agressius amb les fibres dels teixits.
En la indústria tèxtil moderna s'utilitzen cada cop més els enzims en l'acabament dels productes. El principal component del cotó és la cel·lulosa que es troba organitzada en fibres. Mentre que moltes de les fibres són allargades i rectes, algunes petites fibres poden formar estructures protuberants. La correcta aplicació de cel·lulases pot treure aquestes protuberàncies donant lloc a productes més suaus i amb un color més intens. Aquests tècnica anomenada Biopolishing és el mateix principi bàsic d'acció de les cel·lulases dels detergents. En la llana, aquest procés s'anomena Biopolishing de la llana (Biopolishing of wool) i s'utilitzen proteases.
 En l'acabat dels pantalons texans s'utilitzen també cel·lulases. Tradicionalment els texans anomenats Stonewashed jeans eren rentats amb pedra pòmez per destenyir-los i aconseguir el color desitjat . Des del 1992 s'ha estès l'ús de les cel·lulases per fer aquest procés, ara anomenat Biostoning. Les cel·lulases trenquen les fibres de cel·lulosa descolorint els pantalons. Si controlem l'acció d'aquestes cel·lulases aconseguirem no trencar els texans i aconseguir el color desitjat. Els avantatges d'aquest procés respecte al mètode tradicional són que els texans duren més perquè el tractament és menys agressiu i que s'utilitza una quantitat molt inferior d'aigua. Les cel·lulases que s'utilitzen solen ser cel·lulases àcides (amb un pH òptim d'activitat al voltant de 4.5) i cel·lulases neutre (amb un pH òptim d'activitat de 7.0). Aquesta aplicació s'ha convertit en un dels mercats de ventes més grans per a les cel·lulases.
En l'acabat dels pantalons texans s'utilitzen també cel·lulases. Tradicionalment els texans anomenats Stonewashed jeans eren rentats amb pedra pòmez per destenyir-los i aconseguir el color desitjat . Des del 1992 s'ha estès l'ús de les cel·lulases per fer aquest procés, ara anomenat Biostoning. Les cel·lulases trenquen les fibres de cel·lulosa descolorint els pantalons. Si controlem l'acció d'aquestes cel·lulases aconseguirem no trencar els texans i aconseguir el color desitjat. Els avantatges d'aquest procés respecte al mètode tradicional són que els texans duren més perquè el tractament és menys agressiu i que s'utilitza una quantitat molt inferior d'aigua. Les cel·lulases que s'utilitzen solen ser cel·lulases àcides (amb un pH òptim d'activitat al voltant de 4.5) i cel·lulases neutre (amb un pH òptim d'activitat de 7.0). Aquesta aplicació s'ha convertit en un dels mercats de ventes més grans per a les cel·lulases.
Altres enzims utilitzats en la indústria tèxtil són: pectinases (per eliminar les pectines en el procés de Bioscouring), catalasa, peroxidasa i lacasa en els processos de blanquejar i tenyir.

 Adobar les pells significa: donar a les pells o els cuirs el tractament o els tractaments adequats per tal de transformar-los en una matèria que, a més de no ésser putrescible, posseeixi les propietats i l'aspecte necessaris per a l'aplicació pràctica a què vagin destinats. També es pot definir com: Estabilitzar el teixit col·lagènic de la pell per tal de fer-lo imputrescible i menys hidrolitzable.
Adobar les pells significa: donar a les pells o els cuirs el tractament o els tractaments adequats per tal de transformar-los en una matèria que, a més de no ésser putrescible, posseeixi les propietats i l'aspecte necessaris per a l'aplicació pràctica a què vagin destinats. També es pot definir com: Estabilitzar el teixit col·lagènic de la pell per tal de fer-lo imputrescible i menys hidrolitzable.L'adobat de les pells és un procés químic i enzimàtic que consisteix en reforçar l'estructura proteica del col·lagen de la capa de la dermis, eliminant els altres compostos presents, com pèls, lípids i proteïnes solubles. El sistema més antic per adobar el cuir o les pells consisteix en utilitzar extractes vegetals rics en tanins. Aquest procés però pot tardar diverses setmanes o mesos. Al segle XIX es va introduir l'adobat químic que utilitza sulfat de crom. Abans, però, d'aquest procés calen altres passos (curing, soaking i dehairing) on s'utilitzen diversos enzims. Els principals enzims utilitzats són les proteases que ens ajudaran a degradar els pèls de la pell i altres proteïnes dels animals i les lipases per treure el greix. S'aconsegueix així augmentar la qualitat del producte final i reduir l'impacte mediambiental del procés:


Les fibres tèxtils abans de teixir-les han de ser reforçades per a què no es trenquin. Per això s'afegeixen compostos que s'adhereixin a les fibres. El midó, combinat amb petites quantitats d'altres substàncies com gelatina i carboximetilcel·lulosa (cel·lulosa tractada per fer-la soluble en aigua), és un dels compostos més utilitzats.
 Després de teixir cal treure aquest midó i en aquest procés anomenat desizing és on ara s'utilitzen les alfa-amilases (els preparats que es venen per fer aquest procés, a part d'activitat amilasa, també tenen activitats proteasa i cel·lulasa). Abans s'utilitzaven tractaments amb àcids o bases que a part dels efectes negatius dels residus que s'originaven sobre el medi ambient, eren tractaments més agressius amb les fibres dels teixits.
Després de teixir cal treure aquest midó i en aquest procés anomenat desizing és on ara s'utilitzen les alfa-amilases (els preparats que es venen per fer aquest procés, a part d'activitat amilasa, també tenen activitats proteasa i cel·lulasa). Abans s'utilitzaven tractaments amb àcids o bases que a part dels efectes negatius dels residus que s'originaven sobre el medi ambient, eren tractaments més agressius amb les fibres dels teixits.En la indústria tèxtil moderna s'utilitzen cada cop més els enzims en l'acabament dels productes. El principal component del cotó és la cel·lulosa que es troba organitzada en fibres. Mentre que moltes de les fibres són allargades i rectes, algunes petites fibres poden formar estructures protuberants. La correcta aplicació de cel·lulases pot treure aquestes protuberàncies donant lloc a productes més suaus i amb un color més intens. Aquests tècnica anomenada Biopolishing és el mateix principi bàsic d'acció de les cel·lulases dels detergents. En la llana, aquest procés s'anomena Biopolishing de la llana (Biopolishing of wool) i s'utilitzen proteases.
 En l'acabat dels pantalons texans s'utilitzen també cel·lulases. Tradicionalment els texans anomenats Stonewashed jeans eren rentats amb pedra pòmez per destenyir-los i aconseguir el color desitjat . Des del 1992 s'ha estès l'ús de les cel·lulases per fer aquest procés, ara anomenat Biostoning. Les cel·lulases trenquen les fibres de cel·lulosa descolorint els pantalons. Si controlem l'acció d'aquestes cel·lulases aconseguirem no trencar els texans i aconseguir el color desitjat. Els avantatges d'aquest procés respecte al mètode tradicional són que els texans duren més perquè el tractament és menys agressiu i que s'utilitza una quantitat molt inferior d'aigua. Les cel·lulases que s'utilitzen solen ser cel·lulases àcides (amb un pH òptim d'activitat al voltant de 4.5) i cel·lulases neutre (amb un pH òptim d'activitat de 7.0). Aquesta aplicació s'ha convertit en un dels mercats de ventes més grans per a les cel·lulases.
En l'acabat dels pantalons texans s'utilitzen també cel·lulases. Tradicionalment els texans anomenats Stonewashed jeans eren rentats amb pedra pòmez per destenyir-los i aconseguir el color desitjat . Des del 1992 s'ha estès l'ús de les cel·lulases per fer aquest procés, ara anomenat Biostoning. Les cel·lulases trenquen les fibres de cel·lulosa descolorint els pantalons. Si controlem l'acció d'aquestes cel·lulases aconseguirem no trencar els texans i aconseguir el color desitjat. Els avantatges d'aquest procés respecte al mètode tradicional són que els texans duren més perquè el tractament és menys agressiu i que s'utilitza una quantitat molt inferior d'aigua. Les cel·lulases que s'utilitzen solen ser cel·lulases àcides (amb un pH òptim d'activitat al voltant de 4.5) i cel·lulases neutre (amb un pH òptim d'activitat de 7.0). Aquesta aplicació s'ha convertit en un dels mercats de ventes més grans per a les cel·lulases.Altres enzims utilitzats en la indústria tèxtil són: pectinases (per eliminar les pectines en el procés de Bioscouring), catalasa, peroxidasa i lacasa en els processos de blanquejar i tenyir.