Ana Fernandez i Laura Guasch. Curs 2009-2010
Biotransformación:
En general, un proceso industrial puede realizarse por síntesis química o por bioconversión. Los microorganismos tienen la capacidad de modificar químicamente una amplia variedad de compuestos orgánicos de una forma muy específica. Un compuesto orgánico es modificado en una o varias reacciones sencillas que forman parte de procesos biológicos. Estos cambios son denominados transformaciones microbianas o bioconversiones. Estos procesos catalizados por enzimas en la industria son cada día más numerosos, ya que presentan ventajas frente a los catalizadores no biológicos.
Ventajas de la biotranformación:
Métodos de biotransformación:
En la bioconversión microbiana de compuestos orgánicos se pueden emplear los siguientes sistemas:
Biocatalizador:
La gran variedad enzimática que ofrecen los microorganismos es un punto fundamental a la hora de escoger su uso en la industria. Son muchas las reacciones químicas de interés industrial que pueden ser catalizadas por microorganismos.
Existen una serie de características que comparten todos los microorganismos y que suponen ciertas ventajas para su uso en la industria. La más importante, es el pequeño tamaño de la célula microbiana y por tanto la alta relación de superficie-volumen. Otro punto a favor de los microorganismos es que los ambientes capaces de albergar vida microbiana son muy variados. Se han encontrado especies que viven a temperaturas comprendidas entre el punto de congelación del agua y el punto de ebullición, en agua salada y dulce, en presencia y en ausencia de oxígeno. Algunos microorganismos se encuentran capacitados para realizar una extensa gama de reacciones metabólicas y adaptarse así a muchas fuentes diferentes de nutrientes. Esta versatilidad y facilidad de adaptación hace posible que los procesos industriales se fundamenten en nutrientes baratos.
Requisitos de un buen microorganismo:
Un microorganismo de uso industrial debe producir la sustancia de interés, tiene que estar disponible en cultivo puro, debe ser genéticamente estable y tiene que crecer en cultivos a gran escala. Otra característica importante es que el microorganismo industrial tiene que crecer rápidamente y producir el producto deseado en un corto período de tiempo. El microorganismo ha de crecer en un medio de cultivo relativamente barato y disponible en grandes cantidades. Además, un microorganismo industrial no debe ser patógeno para el hombre, ni para animales ni plantas.
Otro requisito importante es la facilidad para separar las células microbianas del medio de cultivo; la centrifugación es dificultosa o cara a gran escala. Los microorganismos industriales más favorables para esto son aquellos de mayor tamaño celular (hongos filamentosos, levaduras y bacterias filamentosas) ya que estas células sedimentas más fácilmente que las bacterias unicelulares e incluso son más fáciles de filtrar. Finalmente el microorganismo tiene que ser susceptible a la manipulación genética, tanto por su naturaleza biológica, como por el conocimiento y disponibilidad de herramientas genéticas adecuadas para realizarla.
Los microorganismos que sintetizan productos útiles para el hombre representan, como máximo, unos pocos centenares de especies entre las más de 100.000 descritas en la naturaleza. Los pocos que se han encontrado con utilidad industrial son necesarios para elaborar alguna sustancia que no se puede obtener de manera fácil o barata por otros métodos.
Ejemplos de biotransformaciones a nivel industrial:
A continuación hablaremos de tres de las biotransformaciones más empleadas en la industria y que aportan más beneficios económicos.
Producción de cortisona a partir de progesterona
La utilización de microorganismos en la biotransformación ha tenido especial éxito en la producción de esteroides, como es el caso de la cortisona. Inicialmente los esteroides se producían mediante extracción de tejidos animales o mediante una síntesis química muy compleja, pero los dos procedimientos eran excesivamente caros. Algunos pasos clave de la síntesis química pueden realizarse de forma más eficaz mediante el uso de enzimas. La mayoría de esteroides que se fabrican hoy en día se hacen mediante un proceso mixto de biotransformación microbiana y transformaciones químicas.
La cortisona es la forma oxidada del cortisol, una hormona esteroidea perteneciente al grupo de los glucocorticoides. Los glucocorticoides son sustancias con importantes actividades biológicas que los hacen útiles en medicina. Tienen propiedades antiinflamatorias, por eso se utilizan como fármacos para el tratamiento de alergias, asma, artritis reumatoide, desordenes dermatológicos, etc.
Existen ciertos trastornos relacionados con la alteración de los niveles de cortisol en el organismo. Uno de ellos es la enfermedad de Addison que consiste en la insuficiente producción de cortisol. El tratamiento para esta enfermedad se basa en la administración de dosis hormonales de cortisol a diario a los pacientes.
 Fig.1 Estructura molecular del cortisol
Fig.1 Estructura molecular del cortisol
El descubrimiento del efecto antiinflamatorio de la cortisona tuvo un gran impacto en el mundo médico de tal manera que Kendall, Reichstein y Hench ganaron el premio Nobel en 1950. La gran demanda de la cortisona impulsó el desarrollo de la síntesis química de este producto.
En 1952 investigadores de Upjohn descubrieron un hongo, Rhizopus nigricans que podía hidroxilar la progesterona (un intermediario en la síntesis de la cortisona) en el C11, reduciendo así las etapas del proceso. Desde entonces, la producción de cortisona se realiza industrialmente mediante éste hongo que contiene unas enzimas que realizan la hidroxilación específica de la progesterona produciendo 11α-hidroxiprogesterona. El átomo de oxígeno del C11 es esencial para el efecto antiinflamatorio de la cortisona. Esta oxidación altamente específica hizo posible reducir la síntesis industrial de cortisona de 31 a 11 pasos. El resto de pasos desde la progesterona hasta la hormona esteroidea cortisona se realizan químicamente.
Después de este descubrimiento, el precio comercial de 1g de cortisona bajó de 200$ a 6$. La producción de esteroides es actualmente un gran negocio, las cifras de venta de los cuatro esteroides principales: cortisona, hidrocortisona, prednisona y prednisolona es de unas 800 toneladas/año.
 Fig.2 Biotransformación de la progesterona para obtener cortisona, mediante el microorganismo Rhizopus nigricans.
Fig.2 Biotransformación de la progesterona para obtener cortisona, mediante el microorganismo Rhizopus nigricans.
Las materias primas que se utilizan en este proceso son la diosgenina, obtenida a partir del barbasco mejicano o el estigmasterol que se obtiene del aceite de soja. A partir de estos esteroles vegetales, mediante procesos químicos se obtiene la progesterona, que es el precursor el cual Rhizopus nigricans realiza la 11β-hidroxilación para obtener la 11α- hidroxiprogesterona.
En el proceso de producción de cortisona, mediante el sistema de células en crecimiento, el microorganismo Rhizopus nigricans se cultiva en grandes fermentadores, en condiciones controladas. El microorganismo se deja crecer de manera exponencial para obtener la máxima cantidad de biomasa antes de añadirle el sustrato. Una vez el microorganismo se ha desarrollado, se añade el esteroide precursor de la cortisona, es decir la progesterona. Después de un período de incubación durante el cual el microorganismo actúa sobre el compuesto químico, se extrae el caldo de fermentación y se recupera el esteroide transformado. El ratio de conversión de la progesterona a 11α- hidroxiprogesterona es del 85%. La purificación del producto depende de si el producto de interés es acumulado en las células o es excretado. Los productos finales de las biotransformaciones suelen ser extracelulares y se pueden encontrar disueltos o en suspensión.
Gracias al reemplazamiento de varios pasos químicos por reacciones especificas catalizadas por enzimas, como es el caso de la 11-hidroxilación de los esteroides, ha sido posible abaratar mucho la producción de cortisona; esteroide que por sus cualidades antiinflamatorias ha tenido un gran impacto médico y supone un gran impulso en la industria de los esteroides.
Producción de ácido cítrico
La fermentación del ácido cítrico fue la primera fermentación industrial aerobia. El ácido cítrico es un ácido tricarboxilico con 6 átomos de carbono que fue aislado inicialmente a partir del jugo de limón. Es una sustancia orgánica producto del metabolismo de la mayoría de los seres vivos, producido en el ciclo de Krebs.
Acido oxalacético + Acetil-CoA = Ácido cítrico
En 1860 comenzó a obtenerse a partir de frutas mediante el uso de sales de calcio, pero eran necesarias enormes cantidades de limones para obtener una cantidad significativa de ácido cítrico. Hoy en día, la obtención a partir de frutos carece de significado. Actualmente se obtiene mediante fermentación con Aspergillus niger partiendo de diversas materias primas. Principalmente se utiliza la melaza de caña, dado que por su composición permite un perfecto desarrollo de los microorganismos, aunque también se utiliza azúcar, hidrolizado de almidón, melaza de remolacha y caldo de caña.
El ácido cítrico es un saborizante muy utilizado por la industria alimentaria. También se utiliza en la manufactura de bebidas alcohólicas como acidulante, como auxiliar en la fabricación de mermeladas y como aditivo general en las industrias de repostería. Para la producción industrial de ácido cítrico se utiliza el hongo Aspergillus.
Aunque las frutas cítricas (como los limones) cuando son verdes pueden contener hasta un 9 % de ácido cítrico, el 99 % de la producción mundial de ácido cítrico se realiza mediante los hongos miceliares. Por tanto, la mayoría de fermentaciones de ácido cítrico se realizan a través de cepas mutadas de A. niger debido a su alta productividad, adaptabilidad en fermentadores industriales, rendimiento económico y mínima producción de productos no deseados.
Procesos bioquímicos de la fermentación aeróbica del ácido cítrico:
El ácido cítrico es una intermediario estándar del ciclo TCA (ciclo de los ácidos tricarboxílicos o también llamado Ciclo de Krebs).
En la fermentación del ácido cítrico, son importantes dos enzimas clave: la citrato aconitasa (CA) y la isocitrato deshidrogenasa (ICDH).
Durante la etapa de producción de ácido cítrico se expresan todas las enzimas del ciclo de Krebs excepto la α-cetoglutarato deshidrogenasa (KGDH). La actividad de citrato sintasa (CS) aumenta por un factor de 10, mientras que las actividades de las enzimas que catabolizan el ácido cítrico, aconitasa (CA) e isocitrato deshidrogenasa (ICDH), se reducen drásticamente. Esto da lugar a una acumulación y excreción de ácido cítrico por el microorganismo sobrecargado.
El hierro es un cofactor necesario para la enzima citrato aconitasa (CA). Por ello, se mantiene un déficit del metal que favorece a la acumulación de ácido cítrico. La restricción de la actividad de esta enzima es la clave para tener éxito en la fermentación del ácido cítrico.
Todas estas variaciones en la expresión de las enzimas del ciclo de Krebs suceden una vez el hongo ha crecido, es decir, cuando se encuentra en la fase estacionaria. Los azúcares son catalizados a través de la glucólisis y van al ciclo de Krebs, produciendo ácido cítrico. Aunque éste sea un metabolito básico ligado al metabolismo primario, su producción se puede considerar como la de un típico metabolito secundario, ya que en primer lugar el micelio va creciendo a partir del carbohidrato (como por ejemplo: sacarosa) y cuando se llega a la fase estacionaria, empieza la idiofase con la excreción del cítrico causada por las disminuciones de las enzimas α-cetoglutarato deshidrogenasa, citrato aconitasa e isocitrato deshidrogenasa y la falta de hierro.
Debido a este motivo, como el ciclo de Krebs se encuentra debilitado, los otros compuestos del ciclo necesarios como intermediarios biosintéticos se sintetizan por rutas anapleróticas (PEPC: fosfoenolpiruvato carboxilasa y la PC: piruvato carboxilasa).
En 50 años se ha multiplicado considerablemente la producción de ácido cítrico a nivel mundial. El ácido cítrico se fabrica en más de 20 países. La Unión Europea, Estados Unidos y China reúnen el 88% del mercado total mundial. La Unión Europea incrementó su elaboración debido fundamentalmente a su uso como materia prima para fabricar detergentes biodegradables.
Producción industrial de penicilina G
La penicilina es un antibiótico que pertenece al grupo de los β-lactámicos. Hay diferentes tipos de penicilina, pero en general esta palabra se utiliza para designar la penicilina G o bencilpenicilina.
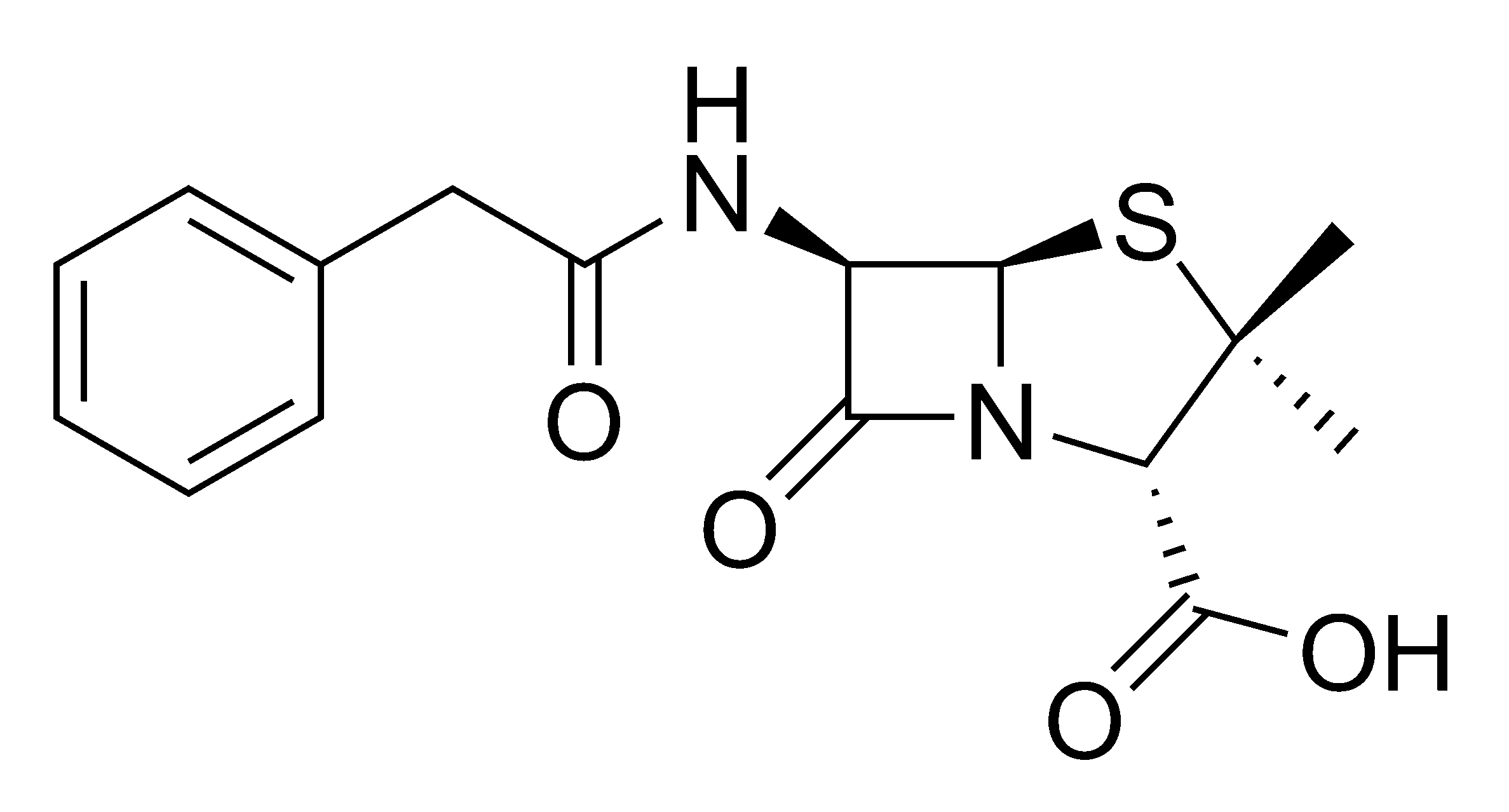 Fig 4. Molécula de penicilina G
Fig 4. Molécula de penicilina G
Un antibiótico es un producto del metabolismo secundario de muchos seres vivos que inhibe el crecimiento de otros organismos o induce la muerte. Son moléculas que actúan sobre las membranas y paredes microbianas, la replicación y la transcripción del DNA, la síntesis de proteínas y, en general, sobre el metabolismo de los microorganismos a diferentes niveles.
La penicilina se utiliza principalmente para combatir infecciones bacterianas, ya que actúa sobre la estructura de la pared. En bacterias grampositivas, se introduce y provoca la entrada descontrolada de agua, dando lugar a la lisis de la célula y la muerte del microorganismo. En cambio, en bacterias gramnegativas, su eficacia es casi nula, debido a la diferente composición de la pared.
La eficacia de los antibióticos no es ilimitada, ya que las bacterias desarrollan factores de resistencia mediante plásmidos o transposones, entre otros. Un mal uso o un abuso de éstos, potencian la resistencia, de manera que cada vez hay que buscar nuevos antibióticos o modificar los existentes para combatir los nuevos microorganismos resistentes.
Hoy en día el hongo más utilizado a nivel industrial para producir penicilina es Penicillium chrysogenum. Aunque, la producción de penicilina no se limita sólo a este microorganismo, sino que también se de en otro microorganismos de los géneros Penicillium, Aspergillus, Trichophyton y Epidermophyton.
Tipos de penicilina:
La molécula de penicilina consiste en un núcleo de ácido 6-aminopenicilánico (6-APA) dentro del cual se distinguen dos anillos: el tiazolidínico o el dihidrotiazínico, dependiendo del tipo de penicilina, y el β-lactámico, común a todas. Además, este núcleo está unido a una cadena lateral (R) que es donde radica la diferencia entre los diferentes tipos de penicilina.
 Figura 5. Estructura general de la penicilina
Figura 5. Estructura general de la penicilina
En general, dentro de los antibióticos β-lactámicos se distinguen dos grande grupos: penicilinas hidrofílicas y penicilinas hidrofóbicas. Como se ha comentado anteriormente ambos grupos comparten el anillo β-lactámico, pero en el caso de las penicilinas hidrofóbicas éste está acompañado por un anillo de cinco átomos llamado anillo tiazolidínico, mientras que en las hidrofílicas el nombre de átomos del anillo es de seis y recibe el nombre de dihidrotiazínico.
Las penicilinas hidrofóbicas se pueden clasificar en 4 grandes grupos, según las condiciones de producción:
Tanto las penicilinas hidrofóbicas como las hidrofílicas son susceptibles a la acción de las β-lactamasas. Estas enzimas catalizan la apertura del anillo β-lactámico, hecho que acaba con la actividad de la molécula. Este problema se supera mediante el uso de inhibidores enzimáticos.
Producción de penicilina G:
El principal microorganismo utilizado en la producción de penicilina a escala industrial es P. chrysogenum. Desde el punto de vista metabólico, P. chrysogenum se clasifica como heterótrofo aerobio. Utiliza, por tanto, glucosa como fuente de carbono y oxígeno como aceptor final de los electrones en la respiración.
Para producir penicilina G existen tres opciones posibles: penicilina G natural, biosintética o sintética. La opción más viable es la segunda a causa de la baja especificidad de la fermentación en la producción natural y el alto coste de la producción sintética. La producción industrial de la penicilina G mediante métodos biosintéticos se realiza a través de fermentaciones fed-batch. En este tipo de procesos es muy importante optimizar los parámetros de temperatura, pH, oxígeno disuelto, nitrógeno asimilable, cantidad de precursor, concentración de azúcares reductores y concentración de biomasa entre otros.
El anillo ß-lactámico-tiazolidínico de la penicilina se produce a partir de L-cisteína y L-valina. La biosíntesis se produce por medio de un dipéptido compuesto de ácido L-a-aminoadípico (L-a-AAA) y L-cisteína. Subsecuentemente se conecta la L-valina mediante una reacción de epimerización, dando lugar a la formación del tripéptido d-(L-a-aminoadipil)-L-cisteinil-D-valina. El primer producto de la ciclación del tripéptido que puede ser aislado es la isopenicilina N, pero no se conocen las reacciones bioquímicas que conducen a este intermediario. La bencilpenicilina se produce en el intercambio de L-a-AAA (L-a-aminoadípico) con ácido fenilacético activado. El 6-APA, que no es un producto intermediario de biosíntesis, se excreta en ausencia de un precursor de la cadena lateral.
Se conocen varios mecanismos reguladores en la biosíntesis de la penicilina. El aminoácido lisina es sintetizado a partir de la vía que origina el ácido L-a-aminoadípico de forma que la penicilina y la lisina comparten una ruta biosintética ramificada común. La lisina inhibe la síntesis de penicilina debido a que inhibe por retroalimentación a la homocitrato sintasa, un enzima implicado en la síntesis de L-a-AAA. Si el L-a-AAA es deficiente, no puede sintetizarse penicilina. Sin embargo, la retrorregulación por lisina no parece ser una etapa limitante en la biosíntesis de penicilina. La biosíntesis de penicilina se ve afectada por la concentración de fosfato y también muestra una clara represión catabólica, particularmente por glucosa.
 Figura 6. Ruta biosintética de la formación de penicilina en P. chrysogenum.
Figura 6. Ruta biosintética de la formación de penicilina en P. chrysogenum.
Un 60% del mercado mundial de antibióticos está representado por los β-lactámicos. Cada año se utilizan 1,6 toneladas de penicilina G directamente como antibiótico. Actualmente, la demanda de penicilina todavía está en aumento, ya sea por el consumo directo del producto en forma de sal (penicilina G, penicilina V, etc.) o por el consumo de algunos de sus derivados obtenidos a partir de la molécula 6-APA, como la ampicilina o la amoxicilina. Aun y así, los precios de la penicilina han ido disminuyendo año tras año debido a la gran producción y, más recientemente, a la aparición de nuevos países productores como China.
Conclusión
Las biotransformaciones ofrecen un gran repertorio de reacciones, algunas de las cuales han emergido como importantes procesos industriales. Para la fabricación de productos orgánicos, la elección del empresario oscila entre la biotransformación y síntesis química, y su decisión es puramente económica.
El ámbito de la biotransformación está evolucionando para aumentar la eficacia del proceso de transformación: la inmovilización de células, esporas y enzimas para aumentar la estabilidad y operar en continuo. Son algunos de los aspectos hacia donde se dirigen las mejoras. La contribución de la genética microbiana a la biotransformación ha sido hasta ahora muy modesta, se espera que la tecnología del DNA recombinante se aproveche para clonar en un sólo organismo los genes que codifican para las diferentes enzimas deseadas y así mejorar la naturaleza económica de las biotransformaciones.
Bibliografía
Biotransformación:
En general, un proceso industrial puede realizarse por síntesis química o por bioconversión. Los microorganismos tienen la capacidad de modificar químicamente una amplia variedad de compuestos orgánicos de una forma muy específica. Un compuesto orgánico es modificado en una o varias reacciones sencillas que forman parte de procesos biológicos. Estos cambios son denominados transformaciones microbianas o bioconversiones. Estos procesos catalizados por enzimas en la industria son cada día más numerosos, ya que presentan ventajas frente a los catalizadores no biológicos.
Ventajas de la biotranformación:
- Especificidad de sustrato: una enzima cataliza una única etapa específica de reacción.
- Regioespecificidad: afecta sólo a una posición específica de la molécula.
- Estereoespecificidad: sólo es transformado o sólo se produce un enantiómero.
- Condiciones de reacción: estas reacciones se realizan en condiciones suaves y poco agresivas.
Métodos de biotransformación:
En la bioconversión microbiana de compuestos orgánicos se pueden emplear los siguientes sistemas:
- Cultivos en crecimiento: Los microorganismos se hacen crecer de manera exponencial para obtener la máxima cantidad de biomasa antes de añadir el sustrato.
- Células inmovilizadas: Tienen la ventaja de que el proceso puede llevarse a cabo en continuo y las células pueden ser reutilizadas. Se facilita la recuperación del metabolito de interés.
- Células en reposo: Con la utilización de este tipo de cultivo se elimina la inhibición del crecimiento por sustrato. Se pueden utilizar elevadas cantidades de células. Esto aumenta la productividad. Facilita la recuperación del producto.
- Enzimas: Se utilizan para evitar reacciones indeseadas, degradación de productos o cuando la membrana celular constituye un obstáculo. Permiten incrementar la velocidad de reacción.
Biocatalizador:
La gran variedad enzimática que ofrecen los microorganismos es un punto fundamental a la hora de escoger su uso en la industria. Son muchas las reacciones químicas de interés industrial que pueden ser catalizadas por microorganismos.
Existen una serie de características que comparten todos los microorganismos y que suponen ciertas ventajas para su uso en la industria. La más importante, es el pequeño tamaño de la célula microbiana y por tanto la alta relación de superficie-volumen. Otro punto a favor de los microorganismos es que los ambientes capaces de albergar vida microbiana son muy variados. Se han encontrado especies que viven a temperaturas comprendidas entre el punto de congelación del agua y el punto de ebullición, en agua salada y dulce, en presencia y en ausencia de oxígeno. Algunos microorganismos se encuentran capacitados para realizar una extensa gama de reacciones metabólicas y adaptarse así a muchas fuentes diferentes de nutrientes. Esta versatilidad y facilidad de adaptación hace posible que los procesos industriales se fundamenten en nutrientes baratos.
Requisitos de un buen microorganismo:
Un microorganismo de uso industrial debe producir la sustancia de interés, tiene que estar disponible en cultivo puro, debe ser genéticamente estable y tiene que crecer en cultivos a gran escala. Otra característica importante es que el microorganismo industrial tiene que crecer rápidamente y producir el producto deseado en un corto período de tiempo. El microorganismo ha de crecer en un medio de cultivo relativamente barato y disponible en grandes cantidades. Además, un microorganismo industrial no debe ser patógeno para el hombre, ni para animales ni plantas.
Otro requisito importante es la facilidad para separar las células microbianas del medio de cultivo; la centrifugación es dificultosa o cara a gran escala. Los microorganismos industriales más favorables para esto son aquellos de mayor tamaño celular (hongos filamentosos, levaduras y bacterias filamentosas) ya que estas células sedimentas más fácilmente que las bacterias unicelulares e incluso son más fáciles de filtrar. Finalmente el microorganismo tiene que ser susceptible a la manipulación genética, tanto por su naturaleza biológica, como por el conocimiento y disponibilidad de herramientas genéticas adecuadas para realizarla.
Los microorganismos que sintetizan productos útiles para el hombre representan, como máximo, unos pocos centenares de especies entre las más de 100.000 descritas en la naturaleza. Los pocos que se han encontrado con utilidad industrial son necesarios para elaborar alguna sustancia que no se puede obtener de manera fácil o barata por otros métodos.
Ejemplos de biotransformaciones a nivel industrial:
A continuación hablaremos de tres de las biotransformaciones más empleadas en la industria y que aportan más beneficios económicos.
Producción de cortisona a partir de progesterona
La utilización de microorganismos en la biotransformación ha tenido especial éxito en la producción de esteroides, como es el caso de la cortisona. Inicialmente los esteroides se producían mediante extracción de tejidos animales o mediante una síntesis química muy compleja, pero los dos procedimientos eran excesivamente caros. Algunos pasos clave de la síntesis química pueden realizarse de forma más eficaz mediante el uso de enzimas. La mayoría de esteroides que se fabrican hoy en día se hacen mediante un proceso mixto de biotransformación microbiana y transformaciones químicas.
La cortisona es la forma oxidada del cortisol, una hormona esteroidea perteneciente al grupo de los glucocorticoides. Los glucocorticoides son sustancias con importantes actividades biológicas que los hacen útiles en medicina. Tienen propiedades antiinflamatorias, por eso se utilizan como fármacos para el tratamiento de alergias, asma, artritis reumatoide, desordenes dermatológicos, etc.
Existen ciertos trastornos relacionados con la alteración de los niveles de cortisol en el organismo. Uno de ellos es la enfermedad de Addison que consiste en la insuficiente producción de cortisol. El tratamiento para esta enfermedad se basa en la administración de dosis hormonales de cortisol a diario a los pacientes.
 Fig.1 Estructura molecular del cortisol
Fig.1 Estructura molecular del cortisolEl descubrimiento del efecto antiinflamatorio de la cortisona tuvo un gran impacto en el mundo médico de tal manera que Kendall, Reichstein y Hench ganaron el premio Nobel en 1950. La gran demanda de la cortisona impulsó el desarrollo de la síntesis química de este producto.
En 1952 investigadores de Upjohn descubrieron un hongo, Rhizopus nigricans que podía hidroxilar la progesterona (un intermediario en la síntesis de la cortisona) en el C11, reduciendo así las etapas del proceso. Desde entonces, la producción de cortisona se realiza industrialmente mediante éste hongo que contiene unas enzimas que realizan la hidroxilación específica de la progesterona produciendo 11α-hidroxiprogesterona. El átomo de oxígeno del C11 es esencial para el efecto antiinflamatorio de la cortisona. Esta oxidación altamente específica hizo posible reducir la síntesis industrial de cortisona de 31 a 11 pasos. El resto de pasos desde la progesterona hasta la hormona esteroidea cortisona se realizan químicamente.
Después de este descubrimiento, el precio comercial de 1g de cortisona bajó de 200$ a 6$. La producción de esteroides es actualmente un gran negocio, las cifras de venta de los cuatro esteroides principales: cortisona, hidrocortisona, prednisona y prednisolona es de unas 800 toneladas/año.
 Fig.2 Biotransformación de la progesterona para obtener cortisona, mediante el microorganismo Rhizopus nigricans.
Fig.2 Biotransformación de la progesterona para obtener cortisona, mediante el microorganismo Rhizopus nigricans.Las materias primas que se utilizan en este proceso son la diosgenina, obtenida a partir del barbasco mejicano o el estigmasterol que se obtiene del aceite de soja. A partir de estos esteroles vegetales, mediante procesos químicos se obtiene la progesterona, que es el precursor el cual Rhizopus nigricans realiza la 11β-hidroxilación para obtener la 11α- hidroxiprogesterona.
En el proceso de producción de cortisona, mediante el sistema de células en crecimiento, el microorganismo Rhizopus nigricans se cultiva en grandes fermentadores, en condiciones controladas. El microorganismo se deja crecer de manera exponencial para obtener la máxima cantidad de biomasa antes de añadirle el sustrato. Una vez el microorganismo se ha desarrollado, se añade el esteroide precursor de la cortisona, es decir la progesterona. Después de un período de incubación durante el cual el microorganismo actúa sobre el compuesto químico, se extrae el caldo de fermentación y se recupera el esteroide transformado. El ratio de conversión de la progesterona a 11α- hidroxiprogesterona es del 85%. La purificación del producto depende de si el producto de interés es acumulado en las células o es excretado. Los productos finales de las biotransformaciones suelen ser extracelulares y se pueden encontrar disueltos o en suspensión.
Gracias al reemplazamiento de varios pasos químicos por reacciones especificas catalizadas por enzimas, como es el caso de la 11-hidroxilación de los esteroides, ha sido posible abaratar mucho la producción de cortisona; esteroide que por sus cualidades antiinflamatorias ha tenido un gran impacto médico y supone un gran impulso en la industria de los esteroides.
Producción de ácido cítrico
La fermentación del ácido cítrico fue la primera fermentación industrial aerobia. El ácido cítrico es un ácido tricarboxilico con 6 átomos de carbono que fue aislado inicialmente a partir del jugo de limón. Es una sustancia orgánica producto del metabolismo de la mayoría de los seres vivos, producido en el ciclo de Krebs.
Acido oxalacético + Acetil-CoA = Ácido cítrico
En 1860 comenzó a obtenerse a partir de frutas mediante el uso de sales de calcio, pero eran necesarias enormes cantidades de limones para obtener una cantidad significativa de ácido cítrico. Hoy en día, la obtención a partir de frutos carece de significado. Actualmente se obtiene mediante fermentación con Aspergillus niger partiendo de diversas materias primas. Principalmente se utiliza la melaza de caña, dado que por su composición permite un perfecto desarrollo de los microorganismos, aunque también se utiliza azúcar, hidrolizado de almidón, melaza de remolacha y caldo de caña.
El ácido cítrico es un saborizante muy utilizado por la industria alimentaria. También se utiliza en la manufactura de bebidas alcohólicas como acidulante, como auxiliar en la fabricación de mermeladas y como aditivo general en las industrias de repostería. Para la producción industrial de ácido cítrico se utiliza el hongo Aspergillus.
Aunque las frutas cítricas (como los limones) cuando son verdes pueden contener hasta un 9 % de ácido cítrico, el 99 % de la producción mundial de ácido cítrico se realiza mediante los hongos miceliares. Por tanto, la mayoría de fermentaciones de ácido cítrico se realizan a través de cepas mutadas de A. niger debido a su alta productividad, adaptabilidad en fermentadores industriales, rendimiento económico y mínima producción de productos no deseados.
Procesos bioquímicos de la fermentación aeróbica del ácido cítrico:
El ácido cítrico es una intermediario estándar del ciclo TCA (ciclo de los ácidos tricarboxílicos o también llamado Ciclo de Krebs).
En la fermentación del ácido cítrico, son importantes dos enzimas clave: la citrato aconitasa (CA) y la isocitrato deshidrogenasa (ICDH).
Durante la etapa de producción de ácido cítrico se expresan todas las enzimas del ciclo de Krebs excepto la α-cetoglutarato deshidrogenasa (KGDH). La actividad de citrato sintasa (CS) aumenta por un factor de 10, mientras que las actividades de las enzimas que catabolizan el ácido cítrico, aconitasa (CA) e isocitrato deshidrogenasa (ICDH), se reducen drásticamente. Esto da lugar a una acumulación y excreción de ácido cítrico por el microorganismo sobrecargado.
El hierro es un cofactor necesario para la enzima citrato aconitasa (CA). Por ello, se mantiene un déficit del metal que favorece a la acumulación de ácido cítrico. La restricción de la actividad de esta enzima es la clave para tener éxito en la fermentación del ácido cítrico.
Todas estas variaciones en la expresión de las enzimas del ciclo de Krebs suceden una vez el hongo ha crecido, es decir, cuando se encuentra en la fase estacionaria. Los azúcares son catalizados a través de la glucólisis y van al ciclo de Krebs, produciendo ácido cítrico. Aunque éste sea un metabolito básico ligado al metabolismo primario, su producción se puede considerar como la de un típico metabolito secundario, ya que en primer lugar el micelio va creciendo a partir del carbohidrato (como por ejemplo: sacarosa) y cuando se llega a la fase estacionaria, empieza la idiofase con la excreción del cítrico causada por las disminuciones de las enzimas α-cetoglutarato deshidrogenasa, citrato aconitasa e isocitrato deshidrogenasa y la falta de hierro.
Debido a este motivo, como el ciclo de Krebs se encuentra debilitado, los otros compuestos del ciclo necesarios como intermediarios biosintéticos se sintetizan por rutas anapleróticas (PEPC: fosfoenolpiruvato carboxilasa y la PC: piruvato carboxilasa).
En 50 años se ha multiplicado considerablemente la producción de ácido cítrico a nivel mundial. El ácido cítrico se fabrica en más de 20 países. La Unión Europea, Estados Unidos y China reúnen el 88% del mercado total mundial. La Unión Europea incrementó su elaboración debido fundamentalmente a su uso como materia prima para fabricar detergentes biodegradables.
Producción industrial de penicilina G
La penicilina es un antibiótico que pertenece al grupo de los β-lactámicos. Hay diferentes tipos de penicilina, pero en general esta palabra se utiliza para designar la penicilina G o bencilpenicilina.
 Fig 4. Molécula de penicilina G
Fig 4. Molécula de penicilina GUn antibiótico es un producto del metabolismo secundario de muchos seres vivos que inhibe el crecimiento de otros organismos o induce la muerte. Son moléculas que actúan sobre las membranas y paredes microbianas, la replicación y la transcripción del DNA, la síntesis de proteínas y, en general, sobre el metabolismo de los microorganismos a diferentes niveles.
La penicilina se utiliza principalmente para combatir infecciones bacterianas, ya que actúa sobre la estructura de la pared. En bacterias grampositivas, se introduce y provoca la entrada descontrolada de agua, dando lugar a la lisis de la célula y la muerte del microorganismo. En cambio, en bacterias gramnegativas, su eficacia es casi nula, debido a la diferente composición de la pared.
La eficacia de los antibióticos no es ilimitada, ya que las bacterias desarrollan factores de resistencia mediante plásmidos o transposones, entre otros. Un mal uso o un abuso de éstos, potencian la resistencia, de manera que cada vez hay que buscar nuevos antibióticos o modificar los existentes para combatir los nuevos microorganismos resistentes.
Hoy en día el hongo más utilizado a nivel industrial para producir penicilina es Penicillium chrysogenum. Aunque, la producción de penicilina no se limita sólo a este microorganismo, sino que también se de en otro microorganismos de los géneros Penicillium, Aspergillus, Trichophyton y Epidermophyton.
Tipos de penicilina:
La molécula de penicilina consiste en un núcleo de ácido 6-aminopenicilánico (6-APA) dentro del cual se distinguen dos anillos: el tiazolidínico o el dihidrotiazínico, dependiendo del tipo de penicilina, y el β-lactámico, común a todas. Además, este núcleo está unido a una cadena lateral (R) que es donde radica la diferencia entre los diferentes tipos de penicilina.
 Figura 5. Estructura general de la penicilina
Figura 5. Estructura general de la penicilinaEn general, dentro de los antibióticos β-lactámicos se distinguen dos grande grupos: penicilinas hidrofílicas y penicilinas hidrofóbicas. Como se ha comentado anteriormente ambos grupos comparten el anillo β-lactámico, pero en el caso de las penicilinas hidrofóbicas éste está acompañado por un anillo de cinco átomos llamado anillo tiazolidínico, mientras que en las hidrofílicas el nombre de átomos del anillo es de seis y recibe el nombre de dihidrotiazínico.
Las penicilinas hidrofóbicas se pueden clasificar en 4 grandes grupos, según las condiciones de producción:
- Penicilinas naturales: Producidas como resultado de un proceso de fermentación típico. Este grupo incluye básicamente la penicilina G.
- Penicilinas biosintéticas: Resultado de la adición al fermentador de precursores específicos de la cadena lateral con el objetivo de producir tan sólo la penicilina deseada. Las penicilinas que se pueden obtener con este método son la penicilina G, la O y la V.
- Penicilinas sintéticas: Obtenidas por síntesis químicas. Su producción es compleja y cara.
- Penicilinas semisintéticas: Obtenidas a partir de la adición química de cadenas laterales a la molécula 6-APA, la cual se ha obtenido previamente por tratamiento químico o enzimático de la penicilina G.
Tanto las penicilinas hidrofóbicas como las hidrofílicas son susceptibles a la acción de las β-lactamasas. Estas enzimas catalizan la apertura del anillo β-lactámico, hecho que acaba con la actividad de la molécula. Este problema se supera mediante el uso de inhibidores enzimáticos.
Producción de penicilina G:
El principal microorganismo utilizado en la producción de penicilina a escala industrial es P. chrysogenum. Desde el punto de vista metabólico, P. chrysogenum se clasifica como heterótrofo aerobio. Utiliza, por tanto, glucosa como fuente de carbono y oxígeno como aceptor final de los electrones en la respiración.
Para producir penicilina G existen tres opciones posibles: penicilina G natural, biosintética o sintética. La opción más viable es la segunda a causa de la baja especificidad de la fermentación en la producción natural y el alto coste de la producción sintética. La producción industrial de la penicilina G mediante métodos biosintéticos se realiza a través de fermentaciones fed-batch. En este tipo de procesos es muy importante optimizar los parámetros de temperatura, pH, oxígeno disuelto, nitrógeno asimilable, cantidad de precursor, concentración de azúcares reductores y concentración de biomasa entre otros.
El anillo ß-lactámico-tiazolidínico de la penicilina se produce a partir de L-cisteína y L-valina. La biosíntesis se produce por medio de un dipéptido compuesto de ácido L-a-aminoadípico (L-a-AAA) y L-cisteína. Subsecuentemente se conecta la L-valina mediante una reacción de epimerización, dando lugar a la formación del tripéptido d-(L-a-aminoadipil)-L-cisteinil-D-valina. El primer producto de la ciclación del tripéptido que puede ser aislado es la isopenicilina N, pero no se conocen las reacciones bioquímicas que conducen a este intermediario. La bencilpenicilina se produce en el intercambio de L-a-AAA (L-a-aminoadípico) con ácido fenilacético activado. El 6-APA, que no es un producto intermediario de biosíntesis, se excreta en ausencia de un precursor de la cadena lateral.
Se conocen varios mecanismos reguladores en la biosíntesis de la penicilina. El aminoácido lisina es sintetizado a partir de la vía que origina el ácido L-a-aminoadípico de forma que la penicilina y la lisina comparten una ruta biosintética ramificada común. La lisina inhibe la síntesis de penicilina debido a que inhibe por retroalimentación a la homocitrato sintasa, un enzima implicado en la síntesis de L-a-AAA. Si el L-a-AAA es deficiente, no puede sintetizarse penicilina. Sin embargo, la retrorregulación por lisina no parece ser una etapa limitante en la biosíntesis de penicilina. La biosíntesis de penicilina se ve afectada por la concentración de fosfato y también muestra una clara represión catabólica, particularmente por glucosa.
 Figura 6. Ruta biosintética de la formación de penicilina en P. chrysogenum.
Figura 6. Ruta biosintética de la formación de penicilina en P. chrysogenum.Un 60% del mercado mundial de antibióticos está representado por los β-lactámicos. Cada año se utilizan 1,6 toneladas de penicilina G directamente como antibiótico. Actualmente, la demanda de penicilina todavía está en aumento, ya sea por el consumo directo del producto en forma de sal (penicilina G, penicilina V, etc.) o por el consumo de algunos de sus derivados obtenidos a partir de la molécula 6-APA, como la ampicilina o la amoxicilina. Aun y así, los precios de la penicilina han ido disminuyendo año tras año debido a la gran producción y, más recientemente, a la aparición de nuevos países productores como China.
Conclusión
Las biotransformaciones ofrecen un gran repertorio de reacciones, algunas de las cuales han emergido como importantes procesos industriales. Para la fabricación de productos orgánicos, la elección del empresario oscila entre la biotransformación y síntesis química, y su decisión es puramente económica.
El ámbito de la biotransformación está evolucionando para aumentar la eficacia del proceso de transformación: la inmovilización de células, esporas y enzimas para aumentar la estabilidad y operar en continuo. Son algunos de los aspectos hacia donde se dirigen las mejoras. La contribución de la genética microbiana a la biotransformación ha sido hasta ahora muy modesta, se espera que la tecnología del DNA recombinante se aproveche para clonar en un sólo organismo los genes que codifican para las diferentes enzimas deseadas y así mejorar la naturaleza económica de las biotransformaciones.
Bibliografía
- G. Birol, C. Undey, and A. Cinar, (2002). A modular simulation package for fed-batch fermentation: penicillin production, Computers and Chemical Engineering 26 no. 11, 1553-1565.
- W. Crueger and A. Crueger, (1984). Biotechnology: A textbook of industrial microbiology. Science tech, inc, Madison, (USA). no. 13, 135-139
- A. L. Demain and R. P. Elander, (1999),.The β-lactam antibiotics: past, present, and future, Antonie van leeuwenhoek 75 no. 1, 5-19.
- Zuluaga Menses, A, López Ríos C.A, Herrera Penagos S.N, Ruiz Colorado A.A, Medina de Pere, V.I.( 2006) “Producción de ácido cítrico con Aspergillus niger NRRL 2270 a partir de suero de leche”. ed. 150, p. 39-57. Disponible en: http://dyna.unalmed.edu.co/ediciones/150/articulos/AR140505/AR140505.pdf
- Medigan. M, Martinko, J. (2003)“Brock Biología de los microorganismos”. Pearson Educación., cap. 30, p.975-976.
- Bordons, A. (2002) “Bioquímica I Microbiologia Industrials”. Col·lecció Eina 21, URV., p.269-271.
- Escuela de medicina de la Pontificia Universidad de Chile. Disponible en: http://escuela.med.puc.cl/publ/ApuntesReumatologia/Drogas.html
- Omar. M, Khanf. F, Lee. H.J. (2008). Synthesis and pharmacology of anti-inflammatory steroidal antedrugs. Chemical reviews, vol.108, nº12, p.5131-5144.


























