Els enzims més utilitzats en la indústria són, en general, hidrolases. Entre elles destaquen les glicosil hidrolases (3.2.1.x), proteases (3.4.x.x) i lipases (3.1.x.x, son de fet esterases).
LES GLICOSIL HIDROLASES:
Les glicosil hidrolases són els enzims encarregats de trencar els enllaços glucosídics entre els monòmers dels oligo i polisacàrids o de trencar l'enllaç glucosídic entre un monòmer i una part no glucosídica. En general, els polisacàrids amb enllaços beta (cel·lulosa, xilà, ...) tenen funcions estructurals i els que tenen enllaços alfa (midó, glicogen, ...) tenen funcions energètiques o de reserva. La lactosa (disacàrid format per una molècula de galactosa i una de glucosa mitjançant un enllaç beta-1,4) és l'excepció. Principals glicosil hidrolases:
- Les alfa-amilases (3.2.1.1), beta-amilases (3.2.1.2) i glucoamilases o amiloglucosidases (3.2.1.3) trenquen els enllaços alfa-1,4 del midó i glicogen (polímers de alfa-glucosa amb unions alfa-1,4 i alfa-1,6). Les alfa-amilases trenquen els enllaços alfa-1,4 interns, a l'atzar; les beta-amilases alliberen maltosa (dímer de dues glucoses unides per un enllaç alfa-1,4) i les amiloglucosidases trenquen els enllaços terminals i alliberen glucosa. Els enllaços alfa-1,6 del midó i glicogen són trencats per l'amilo-alfa(1-6)-glucosidasa i amiloglucosidasa (que tambe presenta una certa activitat per hidrolitzar aquests tipus d'enllaços).
- Les cel·lulases (3.2.1.4 endoglucanases i 3.2.1.91 exoglucanases) i xilanases (3.2.1.8) trenquen els enllaços beta dels polisacàrids cel·lulosa i xilà. Les beta-glucosidases (3.2.1.21) trenquen l'enllaç beta de la cel·lobiosa (disacàrid de glucosa beta-1,4). Per determinar l'activitat enzimàtica de les cel·lulases cal utilitzar substrats solubles com per exemple la carboxi-metil-cel·lulosa.
- Les beta-galactosidases (3.2.1.23) hidrolitzen la lactosa.
El mecanisme de reacció de les glicosil hidrolases és una catàlisi àcida on intervenen dos aminoàcids àcids (glutàmic o aspàrtic), un que actua com a donador de protons i l'altre com a nucleòfil o base (acceptor de protons). En el mecanisme retaining es donen dos atacs nucleòfils, es reté la configuració del carboni anomèric, es forma un intermediari glicosil-enzim i els aminoàcids catalítics han d'estar a una distància de 5.5 A. En el mecanisme inverting no es forma cap intermediari, no es reté la configuració del carboni anomèric i els dos grups àcids estan separats entre 6.5 i 9.5 A, una distància més gran perquè hi ha d'haver lloc per a una molècula d'aigua.
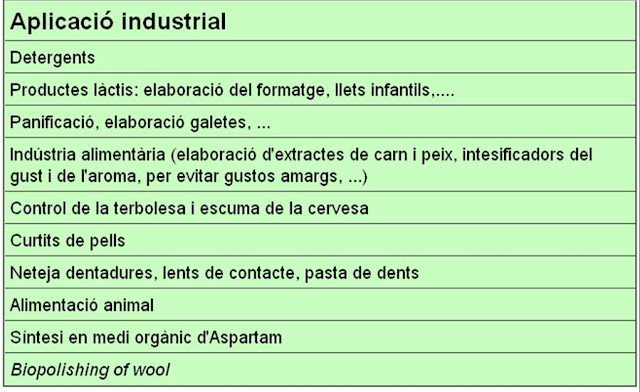
Aplicacions industrials de les glicosil hidrolases:

LES PROTEASES:
Les proteases (3.4.x.x) trenquen l'enllaç peptídic de les proteïnes. Moltes són específiques pel lloc on tallen. El reconeixement dels aminoàcids per on tallen es fa en funció de la seva càrrega i tamany. Les serin-proteases (p.ex. tripsina, elastasa, quimotripsina) tenen tres aminoàcids catalítics una Ser que actúa com a nucleòfil, una His que rep un protó de la Ser i un Asp que estabilitza la càrrega positiva de la His. El pKa del grup -OH de la serina (és a dir, el fet que perdi un protó) és molt diferent del d'una Ser lliure, degut a l'entorn on es troba (la presència d'una His que accepta aquest protó i un Asp que estabilitza la càrrega de la His). En el mecanisme de reacció de les serin-proteases es forma un intermediari acil-enzim i intervé una molècula d'aigua. El mecanisme de reacció de les tiol-proteases (p.ex. papaïna) és semblant a les serin-proteases però enlloc d'una serina trobem una Cys, i enlloc d'un Asp trobem un Trp. El pH òptim de la papaïna (entre 4-8) està comprés entre els valors dels pKas de la Cys i His catalítiques que són 4.2 i 8.2 respectivament. Degut a aquests valors dels pKs, en els valors òptims de pH la Cys es troba desprotonada i la His protonada. Aquests valors són molt diferents dels pKas de la Cys (8.3) i de la His lliure (6.0) i són deguts a l'entorn on es troben.
Aplicacions industrials de les proteases:
LES LIPASES:
Les lipases (3.1.x.x) són esterases que trenquen els enllaços éster dels lípids. Són enzims que han de catalitzar reaccions en una interfase lípid-aigua i per això no segueixen una cinètica típica de Michaelis-Menten. La velocitat de reacció depèn del grau d'emulsió. Habitualment s'extreuen d'animals o microorganismes. El fet que tinguin una elevada enantioselectivitat, siguin estables en medi orgànic i no necessitin cofactors fan que les lipases siguin molt utilitzades en reaccions de síntesi en medis no aquosos. En el mecanisme de reacció de les lipases també intervenen una Ser -fa un atac nucleòfil-, una His -que accepta els protons de la serina- i un Asp -que estabilitza la càrrega positiva de la His. La Ser es troba en la seqüència conservada Gly-X-Ser-X-Gly que forma un gir després d'una cadena beta. En general, els ions Ca2+ augmenten la seva activitat.
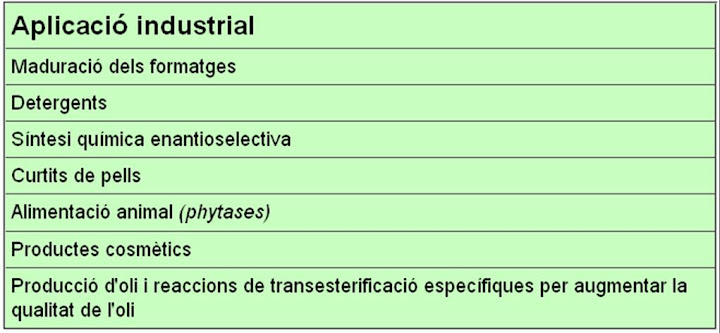
Aplicacions industrials de les lipases:
Utilització dels enzims en l'alimentació animal:
El principal component de l'alimentació animal són materials de plantes com cereals (moresc, ordi, cibada). Mentre que la majoria del midó present en aquests cereals és ràpidament utilitzat pels animals, hi ha una part dels components d'aquests cereals (anomenada factors anti-nutricionals ANF) que no pot ser utilitzada perquè a l'animal li manquen els enzims necessaris. L'addició d'enzims que l'animal no té pot ajudar a digerir aquests ANFs. Alguns dels enzims que s'afegeixen són xilanases, beta-glucanases i proteases.
Una altra aplicació dels enzims en l'alimentació animal és la utilització dels enzims anomenats phytases (E.C. 3.1.3.16 són doncs esterases). El fòsfor en els vegetals s'emmagatzema en forma d'àcid phytic que l'animal no pot utilitzar perquè li falten els enzims adients. Per aquest motiu als pinsos se'ls hi sol afegir fòsfor inorgànic (així la font de P no es una limitació pel creixement dels animals). L'addició de phytases allibera el fòsfor reduint la necessitat d'una suplementació de fòsfor en la dieta dels animals i reduint la quantitat de fosfats dels excrements animals.




Cap comentari:
Publica un comentari a l'entrada